อะตอมและสมบัติของธาตุ
แบบจำลองอะตอม
แบบจำลองอะตอมของทอมสัน
ในปี พ.ศ. 2346 (ค.ศ. 1803) จอห์น ดอลตัน (John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอม
เพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงของสารก่อนและหลังทำปฏิกิริยา รวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบ ซึ่งสรุปได้ดังนี้
1. ธาตุประกอบด้วยอนุภาคเล็กๆหลายอนุภาคเรียกอนุภาคเหล่านี้ว่า “อะตอม” ซึ่งแบ่งแยกและทำให้สูญหายไม่ได้
2. อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน แต่จะมีสมบัติ แตกต่างจากอะตอมของธาตุอื่น
3. สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยา เคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
จอห์น ดอลตัน ชาวอังกฤษ เสนอทฤษฎีอะตอมของดอลตัน
- อะตอมเป็นอนุภาคที่เล็กที่สุด แบ่งแยกอีกไม่ได้
- อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน
- อะตอมต้องเกิดจากสารประกอบเกิดจากอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมตัวกันทางเคมี
ทฤษฎีอะตอมของดอลตันใช้อธิบายลักษณะและสมบัติของอะตอมได้เพียงระดับหนึ่ง แต่ต่อมานักวิทยาศาสตร์ค้นพบข้อมูลบางประการที่ไม่สอดคล้องกับทฤษฎีอะตอมของ ดอลตัน เช่น พบว่าอะตอมของธาตุชนิดเดียวกันอาจมีมวลแตกต่างกันได้
ลักษณะแบบจำลองอะตอมของดอลตัน

แบบจะลองอะตอมของทอมสัน
ในปลายคริสต์ศตวรรษที่ 19 ได้มีการค้นพบรังสีชนิดหนึ่ง ซึ่งเรียกว่า รังสีแคโทด (cathode ray) ที่ได้จากการทดลองของนักวิทยาศาสตร์ชื่อ Julius Plicker ซึ่งใช้หลอดแก้วที่สูบอากาศออก และมีอิเล็กโตรด 2 อันอยู่คนละข้าง (แอโนดเป็นขั้วไฟฟ้าบวก และแคโทดเป็นขั้วไฟฟ้าลบ) ของหลอดแก้ว และต่อไปยังไฟฟ้าที่มีศักย์สูง ทำให้เกิดรังสีขึ้นภายในหลอดแก้ว เรียกว่า รังสีแคโทด




นักวิทยาศาสตร์ได้พยายามศึกษาลักษณะของการจัดอิเล็กตรอนรอบๆ อะตอม โดยแบ่งการศึกษาออกเป็น 2 ส่วน ส่วนแรกเป็นการศึกษษเกี่ยวกับสเปกตรัมของอะตอม ซึ่งทำให้ทราบว่าภายในอะตอมมีการจัดระดับพลังงานเป็นชั้นๆ ในแต่ละชั้นจะมีอิเล็กตรอนบรรจุอยู่ ส่วนที่สองเป็นการศึกษาเกี่ยวกับพลังงานไอโอไนเซชัน เพื่อดูว่าในแต่ละระดับพลังงานจะมีอิเล็กตรอนบรรจุอยู่ได้กี่ตัว
สเปกตรัม หมายถึง อนุกรมของแถบสีหรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้น ที่มีความยาวคลื่นต่างๆเรียงลำดับกันไป
นีลส์โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา สรุปได้ดังนี้
1 . อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นชั้นๆ ตามระดับพลังงาน และแต่ละชั้นจะมีพลังงานเป็นค่าเฉพาะตัว
2. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกว่าระดับพลังงานต่ำสุดยิ่งอยู่ห่างจากนิวเคลียสมากขึ้น ระดับพลังงานจะยิ่งสูงขึ้น
3. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกระดับพลังงาน n = 1 ระดับพลังงานถัดไปเรียกระดับพลังงาน n =2, n = 3,… ตามลำดับ หรือเรียกเป็นชั้น K , L , M , N ,O , P , Q ….
1 . อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นชั้นๆ ตามระดับพลังงาน และแต่ละชั้นจะมีพลังงานเป็นค่าเฉพาะตัว
2. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกว่าระดับพลังงานต่ำสุดยิ่งอยู่ห่างจากนิวเคลียสมากขึ้น ระดับพลังงานจะยิ่งสูงขึ้น
3. อิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะเรียกระดับพลังงาน n = 1 ระดับพลังงานถัดไปเรียกระดับพลังงาน n =2, n = 3,… ตามลำดับ หรือเรียกเป็นชั้น K , L , M , N ,O , P , Q ….
จากทฤษฎีอะตอมของ นีลส์โบร์ แบบจำลองอะตอมมีลักษณะดังรูป

ลักษณะแบบจำลองอะตอมของนีลส์โบร์
คลื่นแม่เหล็กไฟฟ้า
แสง คือ คลื่นแม่เหล็กไฟฟ้า (Electromagnetic waves เรียกย่อๆ ว่า EM) ซึ่งประกอบด้วย สนามแม่เหล็กและสนามไฟฟ้าเคลื่อนที่ทำมุมตั้งฉากกัน ระยะทางระหว่างยอดคลื่นหนึ่งถึงยอดคลื่นถัดไปเรียกว่า ความยาวคลื่น (Wavelength) ดังภาพที่ 1
ภาพที่ 1 คุณสมบัติของคลื่นแม่เหล็กไฟฟ้า
แสงที่ตามองเห็น (Visible light) เป็นส่วนหนึ่งของคลื่นแม่เหล็กไฟฟ้า ในช่วงคลื่น 400 – 700 นาโนเมตร (1 nm = 10-9 m หรือ 1/พันล้านเมตร) หากนำแท่งแก้วปริซึมมาหักเหแสงอาทิตย์ เราจะเห็นว่าแสงสีขาวถูกหักเหออกเป็นสีม่วง คราม น้ำเงิน เขียว เหลือง แสด แดง คล้ายกับสีของรุ้งกินน้ำ เรียกว่า “สเปกตรัม” (Spectrum) แสงแต่ละสีมีความยาวคลื่นแตกต่างกัน สีม่วงมีความยาวคลื่นสั้นที่สุด (400 nm) สีแดงมีความยาวคลื่นมากที่สุด นอกจากแสงที่ตามองเห็นแล้วยังมีคลื่นแม่เหล็กไฟฟ้าชนิดอื่นๆ เรียงตามขนาดความยาวคลื่นจากน้อยไปมาก
ภาพที่ 2 คลื่นแม่เหล็กไฟฟ้าประเภทต่างๆ
นอกจากนักวิทยาศาสตร์จะแบ่งประเภทของคลื่นแม่เหล็กไฟฟ้าโดยใช้ความยาวคลื่นเป็นตัวกำหนดแล้ว แต่บางครั้งในวงการวิทยุโทรคมนาคม เรานิยมใช้ความถี่ของคลื่นเป็นตัวกำหนด เนื่องจากคลื่นแม่เหล็กไฟฟ้าทุกประเภทเดินทางโดยไม่ต้องใช้ตัวกลางด้วยความเร็วคงที่ 300,000,000 เมตร/วินาที เราสามารถคำนวณหาค่าความถี่ได้โดยใช้สูตร
λ = c / f
ความยาวคลื่น = ความเร็วแสง / ความถี่
ความยาวคลื่น (λ) = ระยะห่างระหว่างยอดคลื่น มีหน่วยเป็นเมตร (m)
ความถี่ (f) = จำนวนคลื่นที่เคลื่อนที่ผ่านจุดที่กำหนด ในระยะเวลา 1 วินาที มีหน่วยเป็นเฮิรทซ์ (Hz)
ความเร็วแสง (c) = 300,000,000 เมตร/วินาที (m/s)
แบบจำลองอะตอมของกลุ่มหมอก
สรุปแบบจำลองอะตอมแบบกลุ่มหมอกแบบจำลองนี้เชื่อว่า
1. อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียส
เป็นรูปทรงต่างๆตามระดับพลังงาน 2. ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนไ้ด้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมาก และเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม 3. อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบ แสดงว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่มีหมอกจาง ดังรูปที่แสดงไว้ |

อนุภาคในอะตอมและไอโซโทป
อนุภาคในอะตอม
อะตอมประกอบด้วยอนุภาคมูลฐานที่สำคัญ 3 อนุภาค ได้แก่โปรตอน นิวตรอน และอิเล็กตรอนอนุภาคขนาดเล็กคือโปรตอน, นิวตรอน และอิเล็กตรอน มีคุณสมบัติต่างกันดังตาราง
อนุภาค
|
สัญลักษณ์
|
ประจุ(คูลอมบ์)
|
น้ำหนัก(กิโลกรัม)
|
โปรตอน
|
p
|
+1.60x10-19
|
1.67x10-27
|
นิวตรอน
|
n
|
ไม่มีประจุ
|
1.67x10-27
|
อิเล็กตรอน
|
e-
|
-1.60x10-19
|
9.11x10-31
|
จากตารางอะตอมที่เป็นกลางทางไฟฟ้าจะมีประจุบวกเท่ากับประจุลบ แสดงว่าในอะตอมมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนซึ่งในอะตอมจะมีโปรตอนจำนวนเท่ากับ “เลขอะตอม” จำนวนโปรตอน = จำนวนอิเล็กตรอน โปรตอนกับนิวตรอนเป็นอนุภาคที่มีน้ำหนักมากเมื่อเทียบกับอิเล็กตรอน ดังนั้นมวลของอะตอมก็คือจำนวนโปรตอนรวมกับจำนวนนิวตรอน นั่นคือ “เลขมวล” เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
โปรตอน อนุภาคชนิดนี้เป็นอนุภาคที่ถูกตรึงแน่นอยู่ในนิวเคลียส (Neucleus)มีอนุภาคเป็นบวกจำนวนโปรตอนใน อะตอมของธาตุเรียกว่า อะตอมมิค นัมเบอร์ ถ้าธาตุใดมีอะตอมมิค นัมเบอร์ เท่ากันเรียกธาตุเหล่านี้ว่าเป็นไอโซโทป ซึ่งกันและกันกล่าวคือ เป็นธาตุที่มีจำนวนโปรตอนเท่ากัน แต่มีจำนวนนิวตรอนต่างกัน
นิวตรอน
อนุภาคชนิดนี้เป็นอนุภาคที่ถูกตรึงแน่นอยู่ในนิวเคลียสรวมกับโปรตอนมีน้ำหนักมากกว่าโปรตอนเล็กน้อยและมีคุณสมบัติเป็นกลางทางไฟฟ้า ผลรวมระหว่างโปรตอนและนิวตรอนใน 1 อะตอมของธาตุ เราเรียกว่า อะตอมมิค แมส หรือแมส นัมเบอร์ ถ้าธาตุใดมีแมส นัมเบอร์ เท่ากันแต่อะตอมมิค นัมเบอร์ ไม่เท่ากันเรา เรียกธาตุเหล่านี้ว่าเป็นไอโซบาร์ซึ่งกันและกัน
อิเล็กตรอน
โปรตอน อนุภาคชนิดนี้เป็นอนุภาคที่ถูกตรึงแน่นอยู่ในนิวเคลียส (Neucleus)มีอนุภาคเป็นบวกจำนวนโปรตอนใน อะตอมของธาตุเรียกว่า อะตอมมิค นัมเบอร์ ถ้าธาตุใดมีอะตอมมิค นัมเบอร์ เท่ากันเรียกธาตุเหล่านี้ว่าเป็นไอโซโทป ซึ่งกันและกันกล่าวคือ เป็นธาตุที่มีจำนวนโปรตอนเท่ากัน แต่มีจำนวนนิวตรอนต่างกัน
นิวตรอน
อนุภาคชนิดนี้เป็นอนุภาคที่ถูกตรึงแน่นอยู่ในนิวเคลียสรวมกับโปรตอนมีน้ำหนักมากกว่าโปรตอนเล็กน้อยและมีคุณสมบัติเป็นกลางทางไฟฟ้า ผลรวมระหว่างโปรตอนและนิวตรอนใน 1 อะตอมของธาตุ เราเรียกว่า อะตอมมิค แมส หรือแมส นัมเบอร์ ถ้าธาตุใดมีแมส นัมเบอร์ เท่ากันแต่อะตอมมิค นัมเบอร์ ไม่เท่ากันเรา เรียกธาตุเหล่านี้ว่าเป็นไอโซบาร์ซึ่งกันและกัน
อิเล็กตรอน
อนุภาคชนิดนี้มีคุณสมบัติทางไฟฟ้าเป็นประจุลบ วิ่งอยู่รอบ ๆ นิวเคลียสของอะตอมของธาตุด้วยความเร็วสูงในวงโคจร ที่เฉพาะของมัน เป็นอนุภาคที่มีน้ำหนักน้อย หนักประมาณ เท่าของน้ำหนักของโปรตอนอิเล็กตรอนจะได้รับแรงดึงดูดจากโปรตอนในนิวเคลียสถ้าอิเล็กตรอนเหล่านั้นได้รับพลังงานเพิ่มมันอาจจะ กระโดดออกไปยังเซลล์ต่อไปได้ อิเล็กตรอนในเซลล์รอบนอกสุดมีบทบาทสำคัญมากทั้งในด้านคุณสมบัติทางฟิสิกส์และเคมี โดยเฉพาะในด้านไฟฟ้า อิเล็กตรอนในเซลล์นี้เรียกว่า เวเลนซ์อิเล็กตรอน ถ้าอิเล็กตรอนในเซลล์นี้ได้รับพลังงานเพิ่มมันจะกระโดดหายไปจากอะตอมของธาตุ ทำให้อะตอมมีลักษณะพร่องอิเล็กตรอนจึงมี ีสภาพทางไฟฟ้าเป็นบวก ในทางตรงกันข้ามถ้ามันสูญเสียพลังงาน มันจะ ได้รับอิเล็กตรอนเพิ่มทำให้มีสภาพ ้ทางไฟฟ้าเป็นลบ ดังนั้นอิเล็กตรอนเท่านั้นที่เคลื่อนที่ได้ จึงทำให้เกิดการไหลของกระแสไฟฟ้าโดยปกติสารที่เป็นกลางทางไฟฟ้าจะมีโปรตอนและอิเล็กตรอนเท่ากัน สารใดสูญเสียอิเล็กตรอนจะมี คุณสมบัติทางไฟฟ้าเป็นบวก สารใดที่รับอิเล็กตรอนเพิ่มจะมีคุณสมบัติทางไฟฟ้าเป็นลบ
สรุป
จำนวนโปรตอน = จำนวนอิเล็กตรอน
เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
เราสามารถเขียนเป็นสัญลักษณ์เพื่อระบุเลขอะตอมและเลขมวลได้ดังนี้
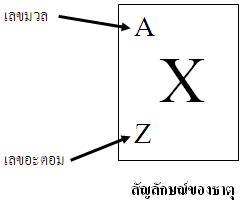
เมื่อ A แทน เลขมวล
Z แทน เลขอะตอม
X แทน สัญลักษณ์ของธาตุ
เช่น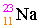
เลขอะตอม = จำนวนโปรตอน = จำนวนอิเล็กตรอน
11 = จำนวนโปรตอน = จำนวนอิเล็กตรอน
X แทน สัญลักษณ์ของธาตุ
เช่น
เลขอะตอม = จำนวนโปรตอน = จำนวนอิเล็กตรอน
11 = จำนวนโปรตอน = จำนวนอิเล็กตรอน
เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
23 = 11 + จำนวนนิวตรอน
จำนวนนิวตรอน = 23 - 11 = 12
นั่นคือ ธาตุโซเดียมมีจำนวนโปรตอน, อิเล็กตรอนและนิวตรอนเท่ากับ 11, 11, 12 ตามลำดับ
23 = 11 + จำนวนนิวตรอน
จำนวนนิวตรอน = 23 - 11 = 12
นั่นคือ ธาตุโซเดียมมีจำนวนโปรตอน, อิเล็กตรอนและนิวตรอนเท่ากับ 11, 11, 12 ตามลำดับ
การจัดเรียงอิเล็กตรอนในอะตอม
จำนวนอิเล็กตรอนในแต่ละระดับพลังงาน

ระดับพลังงานหลักและระดับพลังงานย่อย
ภายในระดับพลังงานหลักอันเดียวกันจะประกอบด้วยพลังงานย่อยเรียงล้าดับจากพลังงานต่้าไปสูง คือ จาก s ไป p d และ f เช่น 3p สูงกว่า 3s ซึ่งเมื่อนำมาเรียงลำดับกันแล้ว พบว่ามีเฉพาะ 2 ระดับพลังงานแรกคือ n = 1 และ n = 2 เท่านั้น ที่มีพลังงานเรียงลำดับกัน แต่พอขึ้นระดับพลังงาน n = 3 เริ่มมีการซ้อนเกยกันของระดับพลังงานย่อย ดังรูป
 รูป แสดงระดับพลังงานในอะตอม
รูป แสดงระดับพลังงานในอะตอม
ออร์บิทัล
จากการศึกษาพบว่ากรณีของอะตอมที่มีหลายอิเล็กตรอนนั้นระดับพลังงานของ 3d จะใกล้กับ 4s มาก และพบว่า ถ้าบรรจุอิเล็กตรอนใน 4s ก่อน 3d พลังงานรวมของอะตอมจะต่ำ และอะตอมจะเสถียรกว่า ดังนั้นในการจัดเรียงอิเล็กตรอนในออร์บิทัลแบบที่เสถียรที่สุด คือการจัดตามระดับพลังงานที่ต่ำที่สุดก่อนทั้งในระดับพลังงานหลักและย่อย ซึ่งวิธีการจัดอิเล็กตรอนสามารถพิจารณาตามลูกศรในรูปที่ 1.8 โดยเรียงลำดับได้เป็น 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p

รูป แสดงลำดับการบรรจุอิเล็กตรอนในออร์บิทัล
หลักการจัดเรียงอิเล็กตรอนในอะตอม
ในการจัดอิเล็กตรอนอาจเขียนเป็นแผนภาพออร์บิทัลซึ่งแสดงสปินของอิเล็กตรอนด้วย ดังตัวอย่าง C มี z = 6 มีโครงแบบอิเล็กตรอนเป็น 1s2 2s2 2p2 ซึ่งการจัดแสดงสปินของอิเล็กตรอนแสดงในตารางที่ 1.1
ในการบรรจุอิเล็กตรอนหรือการจัดเรียงอิเล็กตรอนลงในออร์บิทัลจะต้องยึดหลักในการบรรจุอิเล็กตรอนของอะตอมหนึ่งๆ ลงในออร์บิทัลที่เหมาะสมตามหลักดังต่อไปนี้
1) หลักของเพาลี (Pauli exclusion principle) กล่าวว่า “ไม่มีอิเล็กตรอนคู่หนึ่งคู่ใดในอะตอมที่มีเลขควอนตัมทั้งสี่เหมือนกันทุกประการ” นั่นคืออิเล็กตรอนคู่หนึ่งในออร์บิทัลจะมีค่า n, ℓ, mℓ เหมือนกันได้ แต่ต่างกันที่สปิน
2) หลักของเอาฟ์บาว (Aufbau principle) มีวิธีการดังนี้
2.1) สัญลักษณ์วงกลม O, หรือ _ แทน ออร์บิทัล
ลูกศร ↑↓ แทน อิเล็กตรอน 1 ตัว ที่สปิน ขึ้น-ลง
ลูกศร↑↓ เรียกว่า อิเล็กตรอนคู่ (paired electron)
ลูกศร↑ เรียกว่าอิเล็กตรอนเดี่ยว (single electron)
2.2) บรรจุอิเล็กตรอนเข้าไปในออร์บิทัลที่มีระดับพลังงานต่ำจนครบจำนวนก่อน ดังรูปที่ 1.1
3) กฎของฮุนด์ (Hund’s rule) กล่าวว่า “การบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน (degenerate orbital) จะบรรจุในลักษณะที่ท้าให้มีอิเล็กตรอนเดี่ยวมากที่สุดเท่าที่จะมากได้” ออร์บิทัลที่มีระดับพลังงานมากกว่า 1 เช่น ออรฺบิทัล p และ d เป็นต้น
รูปโครงแบบอิเล็กตรอน (แบบสัญลักษณ์) ของธาตุ
4) การบรรจุเต็ม (filled configuration) เป็นการบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน แบบเต็ม ครบ 2 ตัว ส่วนการบรรจุครึ่ง (half- filled configuration) เป็นการบรรจุอิเล็กตรอนลงในออร์บิทัลแบบครึ่งหรือเพียง 1 ตัว เท่านั้น ซึ่งการบรรจุทั้งสองแบบ (ของเวเลนซ์อิเล็กตรอน) จะทำให้มีความเสถียรมากกว่าตัวอย่างการบรรจุเต็ม เช่น
 รูป การบรรจุอิเล็กตรอนในออรืบิทัลแบบเต็ม
รูป การบรรจุอิเล็กตรอนในออรืบิทัลแบบเต็มตัวอย่างการจัดอิเล็กตรอนของธาตุเลขอะตอม 1 ถึง 18
 รูป การจัดอิเล็กตรอนของธาตุเลขอะตอม 1 ถึง 18
รูป การจัดอิเล็กตรอนของธาตุเลขอะตอม 1 ถึง 18
ตารางธาตุและสมบัติของธาตุหมู่หลัก
วิวัฒนาการของตารางธาตุ
การจัดธาตุเป็นหมวดหมู่ของนักเคมียุคต่าง ๆ
ตารางธาตุ หมายถึง ตารางที่นักวิทยาศาสตร์สร้างขึ้นมา เพื่อแบ่งธาตุที่มีสมบัติเหมือนกันออกเป็นหมวดหมู่ เพื่อให้ง่ายแก่การศึกษา โดยแบ่งธาตุทั้งหมดออกเป็นหมู่และคาบ
ธาตุที่อยู่ในแนวดิ่งเดียวกัน เรียกว่า อยู่ใน หมู่ เดียวกัน
ธาตุที่อยู่ในแนวนอนเดียวกัน เรียกว่า อยู่ใน คาบ เดียวกัน
ในระหว่างปี พ.ศ. 2346 ถึง 2456 มีธาตุต่าง ๆที่พบในธรรมชาติประมาณ 63 ธาตุ ซึ่งนักวิทยาศาสตร์ได้พยายามจัดธาตุเหล่านี้ให้เป็นหมวดหมู่หรือเป็นตารางธาตุโดยในช่วงแรก ๆ นั้นแบ่งธาตุออกเป็นหมวดหมู่โดยอาศัยสมบัติของธาตุ ทั้งนี้ได้จากการสังเกตพบความคล้ายคลึงกันของสมบัติของธาตุเป็นกลุ่ม ๆ ทำให้นำมาจัดเป็นตารางธาตุได้ เช่นแบ่งกลุ่มโดยอาศัยสมบัติเกี่ยวกับโลหะ-อโลหะ โดยอาศัยสมบัติของความเป็นกรด-เบสของธาตุ เป็นต้น ต่อมาเมื่อหามวลอะตอมของธาตุได้ จึงใช้มวลอะตอมมาประกอบในการจัดตารางธาตุ จนในปัจจุบันจัดตารางธาตุโดยอาศัยการจัดเรียงอิเล็กตรอน
1. ตารางธาตุของเดอเบอไรเนอร์
การจัดตารางธาตุนั้นเริ่มขึ้นตั้งแต่ปี พ.ศ. 2360 (ค.ศ. 1817) โดย โยฮันน์ เดอเบอไรเนอร์ (Johaun Dobereiner) นักเคมีชาวเยอรมัน ได้นำธาตุต่าง ๆ ที่พบในขณะนั้นมาจัดเรียงเป็นตารางธาตุ โดยนำธาตุต่าง ๆ ที่มีสมบัติคล้ายคลึงกันมาจัดไว้ในหมู่เดียวกัน หมู่ละ 3 ธาตุ เรียงตามมวลอะตอมจากน้อยไปมากในแต่ละหมู่ มวลอะตอมของธาตุที่อยู่กลางจะเป็นค่าเฉลี่ยของมวลอะตอมของธาตุที่เหลืออีก 2 อะตอม เรียกว่า กฎชุดสาม (law of triads หรือ Dobereine’s law of triads)
ตารางที่ 8 มวลอะตอมเฉลี่ยของธาตุบางกลุ่มตามกฎชุดสาม
ธาตุ
|
มวลอะตอม
|
มวลอะตอมของธาตุแถวที่ 1 และ 3
|
Li
Na
K
Cl
Br
I
|
6.940
22.997
39.096
35.453
79.909
126.197
|
23.018
81.197
|
จะเห็นได้ว่ามวลอะตอมเฉลี่ย มีค่าใกล้เคียงกับมวลอะตอมของธาตุกลาง อย่างไรก็ตาม เมื่อนำกฎดังกล่าวไปใช้กับธาตุกลุ่มอื่นที่มีสมบัติคล้ายคลึงกัน ปรากฏว่าไม่มีผลเท่าที่ควร มวลอะตอมของธาตุกลางไม่เท่ากับค่าเฉลี่ยของมวลอะตอมของธาตุที่เหลือ กฎชุดสามของเดอเบอไรเนอร์จึงไม่เป็นที่ยอมรับกันในเวลาต่อมา
2. ตารางธาตุของนิวแลนด์
ในปี พ.ศ. 2407 (ค.ศ. 1864) จอห์น นิวแลนด์ (John Newlands) นักเคมีชาวอังกฤษได้พบว่าเมื่อนำธาตุต่าง ๆ มาเรียงลำดับตามมวลอะตอมจากน้อยไปหามาก ให้เป็นแถวตามแนวนอน สมบัติของธาตุจะมีลักษณะคล้ายกันเป็นช่วง ๆ ซึ่งลักษณะดังกล่าวเกิดขึ้นทุก ๆ ของธาตุที่ 8
เช่น ถ้าเริ่มต้นจากธาตุ Li แล้วเรียงลำดับมวลอะตอมไปถึงธาตุที่ 8 จะตรงกับ Na ซึ่ง Li และ Na มีสมบัติต่าง ๆ คล้ายคลึงกัน
ตารางที่ 9 ตัวอย่างการจัดตารางธาตุของนิวแลนด์ส์
H
|
Li
|
Be
|
B
|
C
|
N
|
O
|
F
|
Na
|
Mg
|
Al
|
Si
|
P
|
S
|
Cl
|
K
|
Ca
|
Cr
|
Ti
|
Mn
|
Fe
|
เรียกกฎการจัดตารางธาตุของนิวแลนด์ส์ว่า law of octaves หรือ Newlands’ law of octaves อย่างไรก็ตาม กฎนี้ไม่เป็นที่ยอมรับกัน เนื่องจากไม่สามารถอธิบายว่าเหตุใดมวลอะตอมจึงมาเกี่ยวข้องกับความคล้ายคลึงดังกล่าว นอกจากกฎนี้แล้วก็ยังใช้ได้กับ ธาตุที่มีมวลอะตอมต่ำ ๆ ไม่เกิน 20 ธาตุแรกเท่านั้น หลังจากนั้นจะใช้กฎนี้ไม่ได้
3. ตารางธาตุของเมนเดเลเอฟ
ในระหว่างปี พ.ศ. 2412 - 2413 (ค.ศ. 1269 - 1270) ยูลิอุส ไมเออร์ (Julius Meyer) นักวิทยาศาสตร์ชาวเยอรมัน และดิมิทรี เมนเดเลเอฟ (Dimitri Mendelejev) นักวิทยาศาสตร์ชาวรัสเซียได้พบในเวลาใกล้เคียงกันว่าสมบัติต่าง ๆ ของธาตุมีส่วนสัมพันธ์กับมวลอะตอมของธาตุกล่าวคือ “ถ้าเรียงลำดับธาตุตามมวลอะตอมจากน้อยไปหามาก จะพบว่าธาตุ ๆ ต่าง จะมีสมบัติคล้ายคลึงกันเป็นช่วง ๆ ” ซึ่งเมเดเลเอฟได้ตั้งเป็นกฎเรียกว่า “กฎพิริออดิก” หรือกฎตารางธาตุ (Periodic law) และพิมพ์เผยแพร่ในปี พ.ศ. 2412 ก่อนที่ไมเออร์จะพิมพ์เผยแพร่ครั้งหนึ่ง ดังนั้นเพื่อเป็นเกียรติแก่เมนเดเลเอฟ จึงเรียกตารางนี้ว่า “ตารางพีริออดิกของเมนเดเลเอฟ” หรือตารางธาตุของเมนเดเลเอฟ (Mendelejev’ s periodic table)
เกณฑ์ที่สำคัญที่เมนเดเลเอฟใช้ คือ จัดธาตุที่มีสมบัติคล้ายคลึงกันที่ปรากฏซ้ำกันเป็นช่วง ๆ ให้อยู่ในหมู่หรือในแนวตั้งเดียวกัน และพยายามเรียงลำดับมวลอะตอมจากน้อยไปหามาก ในกรณีที่เรียงตามมวลอะตอมแล้วสมบัติของธาตุไม่สอดคล้องกัน ก็พยายามจัดให้เข้าหมู่โดยปล่อยให้ช่องว่างเว้นไว้ในตารางซึ่งเมนเดเลเอฟคิดว่า ช่องว่างเหล่านั้นน่าจะเป็นตำแหน่งของธาตุซึ่งยังไม่มีการค้นพบในขณะนั้น ในการจัดตารางธาตุนอกจากจะใช้มวลอะตอมแล้ว ยังใช้สมบัติทางเคมีและทางกายภาพของสารประกอบอื่น ๆ นอกเหนือจากสารประกอบคลอไรด์ และออกไซด์มาประกอบการพิจารณาด้วย
ตารางที่ 10 ตารางพิริออดิกของเมนเดเลเอฟ
หมู่ 1
|
หมู่ 2
|
หมู่ 3
|
หมู่ 4
|
หมู่ 5
|
หมู่ 6
|
หมู่ 7
|
หมู่ 8
| |
1
|
H 1
| |||||||
2
|
Li 7
|
Be 9.4
|
B 11
|
C 12
|
N 14
|
O 16
|
F 19
| |
3
|
Na 23
|
Mg 24
|
Al 27.3
|
Si 28
|
P 31
|
S 32
|
Cl 35.5
| |
4
|
K 29
|
Ca 40
|
-44
|
Ti 48
|
V 51
|
Cr 52
|
Mn 55
|
Fe 56 Co 59
Ni 59 Cu 63
|
5
|
(Cu 63 )
|
Zn 65
|
-68
|
-72
|
As 75
|
Se 78
|
Br 80
| |
6
|
Rb 85
|
Sr 87
|
? Yt 88
|
Zr 90
|
Nb 94
|
Mo 96
|
-100
|
Ru104 Rh104
Pd105 Ag 108
|
7
|
(Ag 108)
|
Cd 112
|
In 113
|
Sn 118
|
Sb 122
|
Te 125
|
1127
| |
8
|
Cs 133
|
Ba 137
|
? Di 138
|
? Ce 140
|
-
|
-
|
-
|
-
|
9
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
10
|
-
|
-
|
? Er 178
|
? La 180
|
Ta 182
|
W 184
|
-
|
Os 195 Ir197
|
11
|
(Au 199)
|
Hg 200
|
Tl 204
|
Bi 208
|
Bi 208
|
-
|
-
|
Pt 198 Au 199
|
12
|
-
|
-
|
-
|
-
|
-
|
U 240
|
-
|
- -
- -
|
ช่องว่างที่เว้นไว้คือตำแหน่งของธาตุที่ยังไม่พบในสมัยนั้น เนื่องจากตำแหน่งของธาตุในตารางธาตุสัมพันธ์กับสมบัติของธาตุ ทำให้เมนเดเลเอฟสามารถทำนายสมบัติของธาตุไว้ล่วงหน้าได้ด้วย โดยการศึกษาสมบัติเกี่ยวกับจุดหลอมเหลว จุดเดือด ความถ่วงจำเพาะ และความร้อนจำเพาะ รวมทั้งสมบัติเกี่ยวกับสารประกอบคลอไรด์ และออกไซด์
ตัวอย่างเช่น ธาตุที่อยู่ในช่องว่างใต้ Si เมนเดเลเอฟเรียกชื่อว่าธาตุเอคาซิลิคอน อีก 15 ปีต่อมาคือในปี พ.ศ. 2429 (ค.ศ. 1886) เคลเมนส์ วิงค์เลอร์ (Clemens Winkler) นักวิทยาศาสตร์ชาวเยอรมันจึงได้พบธาตุนี้และเรียกชื่อว่า ธาตุเจอร์เมเนียม (Ge) นั่นเอง
ตารางที่ 11 เปรียบเทียบสมบัติของธาตุเอคาซิลิคอนกับเจอร์เมเนียมที่ทำนายและที่ค้นพบ
สมบัติ
|
เอคาซิลิคอนทำนายเมื่อ พ.ศ. 2414 (ค.ศ. 1871)
|
เจอร์เมเนียมพบเมื่อ
พ.ศ. 2429 (ค.ศ.1886)
|
มวลอะตอม
สีของธาตุ
ความหนาแน่น (g/cm3)
จุดหลอมเหลว (0C )
สูตรของออกไซด์
ความหนาแน่นของออกไซด์ (g/cm3)
เมื่อผสมกับกรดไฮโดรคลอริก
|
72
เป็นโลหะสีเทา
5.5
สูง
GeO2
4.7
ละลายได้เล็กน้อย
|
72.6
เป็นโลหะสีเทา
5.36
958
GeO2
4.70
ไม่ละลายที่ 25 0C
|
นอกจากธาตุเอคาซิลิคอนแล้ว ยังมีธาตุอื่นที่เมนเดเลเอฟ ได้เรียกชื่อไว้ล่วงหน้า เช่น
ธาตุที่อยู่ใต้ B เรียกว่า เอคาโบรอน
ธาตุที่อยู่ใต้ Al เรียกว่า เอคาอะลูมิเนียม
ซึ่งปัจจุบันก็คือธาตุ Se และ Ga ตามลำดับ
การจัดตารางธาตุของเมนเดเลเอฟนั้น ถ้ายึดหลักการเรียงตามมวลอะตอมจากน้อยไปหามากอย่างเคร่งครัด จะทำให้ธาตุบางธาตุซึ่งมีสมบัติแตกต่างกันอยู่ในหมู่เดียวกัน ทำให้ต้องยกเว้นไม่เรียงตามมวลอะตอมบ้างแต่เมนเดเลเอฟก็ไม่สามารถให้เหตุผลได้ว่าเป็นเพราะเหตุใดจึงต้องเรียงลำดับธาตุเช่นนั้น เนื่องจากในขณะนั้นยังไม่มีความเข้าใจเกี่ยวกับโครงสร้างของอะตอมไม่มากพอ นักวิทยาศาสตร์ต่อ ๆ มาจึงสร้างแนวคิดใหม่ว่า ตำแหน่งของธาตุในตารางธาตุไม่ควรขึ้นอยู่กับมวลอะตอม แต่ควรจะขึ้นอยู่กับสมบัติอื่น ๆ ที่สัมพันธ์กับมวลอะตอม
4. ตารางธาตุของเฮนรี โมสลีย์
เฮนรี โมสลีย์ (Henry Moseley) นักวิทยาศาสตร์ชาวอังกฤษ ได้แก้ไขตารางธาตุของเมนเดเลเอฟให้ถูกต้องขึ้น โดยการพบว่าเลขอะตอม หรือจำนวนโปรตอนในนิวเคลียสของธาตุ มีความสัมพันธ์กับสมบัติของธาตุมากกว่ามวลอะตอม ทำให้สอดคล้องกับกฎพีริออดิกมากกว่า สามารถสร้างตารางธาตุได้โดยไม่ต้องสลับที่ธาตุบางธาตุเหมือนกรณีการจัดเรียงตามมวลอะตอม
ประมาณปี พ.ศ. 2456 (ค.ศ. 1913) โมสลีย์จึงเสนอตารางธาตุใหม่โดยเรียงตามเลขอะตอมจากน้อยไปหามาก และจัดธาตุที่มีสมบัติคล้ายคลึงกันให้อยู่ในหมู่เดียวกัน และกำหนดกฎตารางธาตุขึ้นใหม่เป็น “สมบัติต่าง ๆ ของธาตุในตารางธาตุขึ้นอยู่กับเลขอะตอมของธาตุ”
ตารางธาตุในปัจจุบัน
เนื่องจากปัจจุบันนักเคมีพบว่า การจัดเรียงตัวของอิเล็กตรอนในอะตอมของธาตุมีส่วนสัมพันธ์กับสมบัติต่าง ๆ ของธาตุ กล่าวคือ ถ้าเรียงลำดับธาตุตามเลขอะตอมจากน้อยไปหามาก จะพบว่าธาตุที่มีสมบัติคล้ายคลึงกันเป็นช่วง ๆ ตามลักษณะของการจัดเรียงอิเล็กตรอนในอะตอมของธาตุนั้น ดังนั้นในปัจจุบันจึงจัดตารางธาตุโดยเรียงตามเลขอะตอมจากน้อยไปมาก ดังในรูปที่ 1.23
รูปที่ 1.23 ตารางธาตุในปัจจุบัน (ที่มา: www.specialedprep.net/.../compounds1.htm)
ตารางธาตุในรูปที่ 1.23 เป็นแบบที่ใช้กันอยู่มากในปัจจุบัน แบ่งธาตุในแนวตั้งออกเป็น 18 แถวหรือ 18 หมู่ โดยธาตุทั้งหมด 18 แถว แบ่งเป็น 2 กลุ่มใหญ่ ๆ คือกลุ่ม A และ B กลุ่ม A มี 8 หมู่ คือหมู่ IA ถึง VIIIA ส่วนกลุ่ม B ซึ่งอยู่ระหว่างหมู่ IIA และ IIIA มี 8 หมู่เช่นเดียวกัน คือ หมู่ IB ถึง VIIIB (แต่มี 10 แนวตั้ง) เรียกธาตุกลุ่ม B ว่า ธาตุทรานซิชัน(Transition Elements)
ธาตุในแต่ละหมู่ ของกลุ่ม A ถ้ามีสมบัติคล้ายกันจะมีชื่อเรียกเฉพาะหมู่ เช่น
* ธาตุหมู่ IA เรียกว่า โลหะอัลคาไล (alkali metal) ได้แก่ Li , Na , K , Rb , Cs , Fr
* ธาตุหมู่ IIA เรียกว่า โลหะอัลคาไลน์เอิร์ท(alkaline earth)ได้แก่ Be Mg Ca Sr Ba Ra
* ธาตุหมู่ VIIA เรียกว่า ธาตุเฮโลเจน (halogen) ได้แก่ F Cl Br I At
* ธาตุหมู่ที่ VIIIA เรียกว่า ก๊าซเฉื่อย (Inert gas) ได้แก่ He Ne Ar Kr Xe Rn
สำหรับการแบ่งธาตุเป็นคาบ ธาตุทั้งหมดในตารางธาตุแบ่งเป็น 7 คาบ ซึ่งในแต่ละคาบอาจจะมีจำนวนธาตุไม่เท่ากัน เช่น
สำหรับคาบต่าง ๆ ในตารางธาตุแบ่งเป็น 7 คาบดังนี้
* คาบที่ 1 มี 2 ธาตุ คือ H , He
* คาบที่ 2 มี 8 ธาตุ คือ ตั้งแต่ Li ถึง Ne
* คาบที่ 3 มี 8 ธาตุ คือ ตั้งแต่ Na ถึง Ar
* คาบที่ 4 มี 18 ธาตุ คือ ตั้งแต่ K ถึง Kr
* คาบที่ 5 มี 18 ธาตุ คือ ตั้งแต่ Rb ถึง Xe
* คาบที่ 6 มี 32 ธาตุ คือ ตั้งแต่ Cs ถึง Rn
* คาบที่ 7 มี 19 ธาตุ คือ ตั้งแต่ Fr ถึง Ha
รวมทั้งหมด 105 ธาตุ เป็นก๊าซ 11 ธาตุ คือ H , N , O , F , Cl , He , Ne , Ar ,
Kr , Xe และ Rn เป็นของเหลว 5 ธาตุ คือ Cs , Fr , Hg , Ga และ Br ที่เหลือเป็นของแข็ง
สำหรับ 2 แถวล่างเลขอะตอม 57 - 70 และ 89 - 102 เป็นธาตุกลุ่มย่อยที่แยกมาจากหมู่ IIIB ในคาบที่ 6 และ 7 เรียกธาตุในกลุ่มย่อยนี้รวม ๆ ว่า กลุ่มธาตุเลนทาไนด์ และ กลุ่มธาตุแอกทิไนด์
นอกจากนี้เมื่อพิจารณาธาตุหมู่ IIIA ไปทางขวามือ จะพบเส้นหนักหรือเส้นทึบเป็นแบบขั้นบันได เส้นหนักนี้จะเป็นเส้นแบ่งกลุ่มธาตุโลหะและอโลหะ กล่าวคือ ธาตุทางขวาของเส้นขั้นบันไดจะเป็นอโลหะ ธาตุทางซ้ายมือของเส้นขั้นบันไดจะเป็นโลหะ ธาตุที่อยู่ชิดกับเส้นขั้นบันได เป็นธาตุกึ่งโลหะ ซึ่งมีทั้งสมบัติของโลหะและอโลหะ เช่น ธาตุ B , Si ,Ge ,As , Sb , Te
การตั้งชื่อธาตุที่ค้นพบใหม่
จากตารางธาตุในรูปที่ 1.23 จะพบว่ามีธาตุอยู่ 118 ธาตุ ซึ่งยังมีการค้นพบธาตุใหม่ ๆ เพิ่มขึ้นอีกหลายธาตุ แต่ยังไม่ได้กำหนดสัญลักษณ์ที่แน่นอนไว้ในตารางธาตุ ธาตุบางธาตุถูกค้นพบโดยนักวิทยาศาสตร์หลายคณะ ทำให้มีชื่อเรียกและสัญลักษณ์ต่างกัน
เช่น ธาตุที่ 104 ค้นพบโดยคณะนักวิทยาศาสตร์ 2 คณะ คือ คณะของนักวิทยาศาสตร์สหรัฐอเมริกา ซึ่งเรียกชื่อว่า รัทเทอร์ฟอร์เดียม (Ratherfordium) และใช้สัญลักษณ์ Rf ในขณะที่คณะนักวิทยาศาสตร์สหภาพโซเวียตเรียกชื่อว่าเคอร์ซาโตเวียม(Kurchatovium) ใช้สัญลักษณ์ Ku
ธาตุที่ 105 ค้นพบโดยคณะนักวิทยาศาสตร์ 2 คณะเช่นเดียวกัน คือคณะนักวิทยาศาสตร์สหรัฐอเมริกาเรียกชื่อว่า ฮาห์เนียม (Hahnium) และใช้สัญลักษณ์ Ha ในขณะที่นักวิทยาศาสตร์สหภาพโซเวียตใช้ชื่อว่า นิลส์บอห์เรียม (Neilbohrium) และใช้สัญลักษณ์เป็น Ns
การที่คณะนักวิทยาศาสตร์ต่างคณะตั้งชื่อแตกต่างกัน ทำให้เกิดความสับสน International Union of Pure and Applied Chemistry (IUPAC) จึงได้กำหนดระบบการตั้งชื่อขึ้นใหม่ โดยใช้กับชื่อธาตุที่มีเลขอะตอมเกิน 100 ขึ้นไป ทั้งนี้ให้ตั้งชื่อธาตุโดยระบุเลขอะตอมเป็นภาษาละติน แล้วลงท้ายด้วย ium ระบบการนับเลขในภาษาละตินเป็นดังนี้
0 = nil (นิล) 1 = un (อุน)
2 = bi (ไบ) 3 = tri (ไตร)
4 = quad (ควอด) 5 = pent (เพนท์)
6 = hex (เฮกซ์) 7 = sept (เซปท์)
8 = oct (ออกตฺ) 9 = enn (เอนน์)
เช่น - ธาตุที่ 104 ตามระบบ IUPAC อ่านว่า อุนนิลควอเดียม (Unnilquadium) สัญลักษณ์ Unq
- ธาตุที่ 105 ตามระบบ IUPAC อ่านว่า อุนนิลเพนเทียม (Unnilpentium) สัญลักษณ์ Unp
การจัดตารางธาตุเป็นหมู่เป็นคาบ ทำให้ศึกษาสมบัติต่าง ๆ ของธาตุได้ง่ายขึ้น สามารถทำนายสมบัติบางประการของธาตุบางธาตุได้ กล่าวคือธาตุที่อยู่ในหมู่เดียวกันจะมีสมบัติต่าง ๆ คล้าย ๆ กัน และธาตุที่อยู่ในคาบเดียวกัน จะมีแนวโน้มของการเปลี่ยนแปลงสมบัติต่าง ๆ ต่อเนื่องกันไป
สมบัติของธาตุตามหมู่และตามคาบ
1. ขนาดอะตอม
การบอกขนาดอะตอมจะบอกโดยใช้รัศมีอะตอม ซึ่งมีค่าเท่ากับครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมทั้งสองที่มีแรงยึดเหนี่ยวอะตอมไว้ด้วยกันหรือที่อยู่ชิดกัน รัศมีอะตอมมีหลายแบบ ขึ้นอยู่กับชนิดของแรงที่ยึดเหนี่ยวระหว่างอะตอม
– รัศมีโคเวเลนต์ คือ ระยะทางครึ่งหนึ่งของความยาวพันธะโคเวเลนต์ระหว่างอะตอมชนิดเดียวกัน
ตัวอย่างรัศมีโคเวเลนต์
– รัศมีแวนเดอร์วาลล์ คือระยะทางครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมที่อยู่ใกล้ที่สุด
ตัวอย่างรัศมีแวนเดอร์วาลล์
– รัศมีโลหะ คือ ระยะทางครึ่งหนึ่งของระยะระหว่างนิวเคลียสของอะตอมโลหะที่อยู่ใกล้กันมากที่สุด

แนวโน้มขนาดอะตอมในตารางธาตุ

2. รัศมีไอออน
ไอออน คือ อะตอมของธาตุ หรือกลุ่มอะตอมของธาตุที่มีประจุ คือ ไอออนทุกชนิดจะต้องมีจำนวนโปรตอนไม่เท่ากับอิเล็กตรอนถ้าจำนวนโปรตอนมากกว่าอิเล็กตรอนเป็นไอออนบวก และถ้ามีจำนวนโปรตอนน้อยกว่าอิเล็กตรอนเป็นไอออนลบ
การบอกขนาดไอออนทำได้เช่นเดียวกับการบอกขนาดอะตอม ซึ่งพิจารณาจากระยะห่างระหว่างนิวเคลียสของไอออนคู่หนึ่งๆ ที่มีแรงยึดเหนี่ยวซึ่งกันและกันในโครงผลึก

ตัวอย่างรัศมีไอออน
แนวโน้มของขนาดไอออนในตารางธาตุ

3. พลังงานไออนไนเซชัน (Ionization Energy; IE)
คือ พลังงานจำนวนน้อยที่สุดที่ใช้ดึงอิเล็กตรอนออกจากอะตอมของธาตุที่เป็นแก๊สครั้งละ 1 อิเล็กตรอนทำให้กลายเป็นไอออนบวกที่เป็นแก๊ส
สามารถเขียนสมการได้ดังนี้
X(g) + IE —-> X+ (g) + e–
ตัวอย่าง ค่า IE1 ถึง IE3 ของ Li
Li(g)  Li+(g) + e– IE1 = 520 kJ/mol
Li+(g) + e– IE1 = 520 kJ/mol
Li+(g)  Li2+(g) + e– IE2 = 7,394 kJ/mol
Li2+(g) + e– IE2 = 7,394 kJ/mol
Li2+(g)  Li3+(g) + e– IE3 = 11,815 kJ/mol
Li3+(g) + e– IE3 = 11,815 kJ/mol
ตัวอย่างกราฟไอออนไนเซชัน
แนวโน้มค่า IE

4. อิเล็กโตรเนกาติวิตี (Electronegativity; EN)
คือ ค่าที่แสดงความสามารถในการดึงอิเล็กตรอนเข้าหาตัวเองของอะตอมของธาตุ ในพันธะเคมีหนึ่ง อะตอมที่มีค่า EN สูงจะดึงดูดอิเล็กตรอนได้ดีกว่าอะตอมที่มี EN ต่ำ

ลักษณะทั่วไป
- โลหะทั่วไปมีค่า EN ต่ำกว่า จึงเสียอิเล็กตรอนได้ง่ายกว่าเกิดไอออนบวก อโลหะทั่วไปมีค่า EN สูง จึงชิงอิเล็กตรอนได้ดีเกิดไอออนลบ ธาตุเฉื่อยไม่มีค่า EN
- ค่า EN ขึ้นอยู่กับ
ก. ขนาดอะตอม หรือจำนวนระดับพลังงาน
ข. ถ้าอะตอมที่มีจำนวนระดับพลังงานเท่ากัน ค่า EN ขึ้นอยู่กับจำนวนโปรตอนในนิวเคลียสเป็นเกณฑ์
5. สัมพรรคภาพอิเล็กตรอน (Electron Affinity; EA)
สัมพรรคภาพอิเล็กตรอน คือ พลังงาน ที่อะตอมในสถานะแก๊ส คายออกมา เมื่อได้ รับอิเล็กตรอน

6. จุดเดือดและจุดหลอมเหลว

แนวโน้มจุดเดือดและจุดหลอมเหลว ตามหมู่
- หมู่ IA IIA และ IIIA ลดลงจากบนลงล่าง (ลดตามเลขอะตอมที่เพิ่มขึ้น)
- หมู่ VA VIA VIIA และ VIIIA เพิ่มขึ้นจากบนลงล่าง (เพิ่มตามเลขอะตอม)
- หมู่ IVA มีแนวโน้มที่ไม่แน่นอน
ตามคาบ
- หมู่ IA IIA IIIA และ IVA แนวโน้มสูงขึ้น
- หมู่ IVA มีจุดเดือดและจุดหลอมเหลวสูงที่สุด เพราะบางธาตุมีโครงสร้างเป็นผลึกร่างตาข่าย
- หมู่ VA VIA VIIA และ VIIIA จุดเดือด จุดหลอมเหลวต่ำ เนื่องจากมีแรงยึดเหนี่ยวระหว่างโมเลกุลที่มีค่าต่ำมาก
7. เลขออกซิเดชัน (Oxidation Number)
เลขออกซิเดชัน คือ เลขที่แสดงถึงค่าประจุไฟฟ้าหรือประจุไฟฟ้าสมมติของไอออนหรืออะตอมของธาตุ
ธาตุแทรนซิชัน
ธาตุแทรนซิชัน คือ กลุ่มธาตุที่อยู่ระหว่างหมู่ IIA กับ IIIA ซึ่งก็คือธาตุหมู่ B ทั้งหมด ประกอบด้วยหมู่ IB – VIIIB รวมทั้ง อินเนอร์แทรนซิชัน ได้แก่ กลุ่มแลนทาไนด์ และกลุ่มแอกทิไนด์
ธาตุแทรนซิชัน เป็นธาตุที่ใช้อิเล็กตรอนในระดับพลังงานย่อย ในการเกิดพันธะ ยกเว้นธาตุหมู่ 2B ที่ใช้อิเล็กตรอนในระดับพลังงานย่อย s ในการเกิดพันธะ
(10).jpg)
สมบัติของโลหะทรานซิชัน
- โลหะทรานซิชันทุกธาตุจะเป็นโลหะ แต่มีความเป็นโลหะน้อยกว่าธาตุหมู่ IA และ IIA
- มีสถานะเป็นของแข็งที่อุณหภูมิห้อง ยกเว้นปรอทที่เป็นของเหลว
- มีจุดหลอมเหลว จุดเดือด และความหนาแน่นสูง
- นำไฟฟ้าได้ดี ซึ่งในโลหะทรานซิชัน ธาตุที่นำไฟฟ้าได้ดีที่สุดคือ เงิน (คาบ 5) และรองลงมาคือ ทอง (คาบ 6)
- นำความร้อนได้ดี
- ธาตุทรานซิชันทั้งหมดมีเวเลนซ์อิเล็กตรอนเท่ากับ 2 ยกเว้นธาตุโครเมียม และทองแดง ที่มีเวเลนซ์อิเล็กตรอนเป็น 1
- สารประกอบของธาตุเหล่านี้จะมีสีสัน
- มีพลังงานไอออไนเซชันลำดับที่ 1 และอิเล็กโทรเนกาติวิตีมาก
- ขนาดอะตอม จะมีขนาดไม่แตกต่างกันมากโดยที่
- ในคาบเดียวกันจะเล็กจากซ้ายไปขวา
- ในหมู่เดียวกันจะใหญ่จากบนลงล่าง
- ธาตุเหล่านี้มีหลายออกซิเดชั่นสเตตส์ (oxidation states)
- ธาตุเหล่านี้เป็นตัวเร่งปฏิกิริยา (catalysts) ที่ดี
- ธาตุเหล่านี้มีสีฟ้า-เงินที่อุณหภูมิห้อง (ยกเว้นทองคำและทองแดง)
- สารประกอบของธาตุเหล่านี้สามารถจำแนกโดยการวิเคราะห์ผลึก
ธาตุกัมมันตรังสี
ธาตุกัมมันตรังสี หมายถึงธาตุที่แผ่รังสีได้ เนื่องจากนิวเคลียสของอะตอมไม่เสถียร เป็นธาตุที่มีเลขอะตอมสูงกว่า 82กัมมันตภาพรังสี หมายถึงปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่อง รังสีที่ได้จากการสลายตัว มี 3 ชนิด คือ รังสีแอลฟา รังสีบีตา และรังสีแกมมา
ในนิวเคลียสของธาตุประกอบด้วยโปรตอนซึ่ง มีประจุบวกและนิวตรอนซึ่งเป็นกลางทางไฟฟ้า สัดส่วนของจำนวนโปรตอนต่อจำนวนนิวตรอนไม่เหมาะสมจนทำให้ธาตุนั้นไม่เสถียร ธาตุนั้นจึงปล่อยรังสีออกมาเพื่อปรับตัวเองให้เสถียร ซึ่งเป็นกระบวนการที่เกิดขึ้นเองตามธรรมชาติ เช่น
(ธาตุยูเรเนียม) (ธาตุทอเลียม) (อนุภาคแอลฟา)
จะเห็นได้ว่า การแผ่รังสีจะทำให้เกิดธาตุใหม่ได้ หรืออาจเป็นธาตุเดิมแต่จำนวนโปรตอนหรือนิวตรอนอาจไม่เท่ากับธาตุเดิม และธาตุกัมมันตรังสีแต่ละธาตุ มีระยะเวลาในการสลายตัวแตกต่างกันและแผ่รังสีได้แตกต่างกัน เรียกว่า ครึ่งชีวิตของธาตุ
กัมมันตภาพรังสี (radioactivity) เกิดจากการเสื่อมสลายโดยตัวเองของนิวเคลียสของอะตอมที่ไม่เสถียร เป็นผลให้ได้อนุภาคอัลฟา อนุภาคเบต้า และรังสีแกมมาซึ่งเป็นคลื่นแม่เหล็กไฟฟ้าที่มีช่วงคลื่นสั้นมากและมีพลังงาน สูง ทั้งหมดนี้พุ่งออกมาด้วยความเร็วสูงมาก ในบางกรณีอาจมีพลังงานความร้อนและพลังงานแสงเกิดตามมาด้วย เช่น การเสื่อมสลายของนิวเคลียสของธาตุเรเดียมไปเป็นธาตุเรดอน
ในปี พ.ศ. 2439 อองตวน อองรี แบ็กเกอแรล (Antcine Henri Bacquerel) นักวิทยาศาสตร์ชาวฝรั่งเศส ได้พบว่าแผ่นฟิล์มถ่ายรูปที่มีกระดาษดำห่อหุ้มอยู่ และเก็บรวมกันไว้กับสารประกอบของยูเรเนียม มีลักษณะเหมือนถูกแสง จึงทำการทดสอบกับสารประกอบของยูเรเนียมชนิดอื่นๆ พบว่าให้ผลการทดลองเช่นเดียวกัน แบ็คเกอเรลจึงสรุปเป็นเบื้องต้นว่า มีการแผ่รังสีออกมาจากธาตุยูเรีเนียม ต่อมาปีแอร์ กูรี (Pierre Curie) และมารี กูรี (marie Curie) นักวิทยาศาสตร์ชาวฝรั่งเศส
ก็ได้พบว่าธาตุอื่น ๆ เช่น พอลโลเนียม (Po) เรเดียม (Ra) และทอเรียม (Th) ก็สามารถแผ่รังสีได้เช่นเดียวกัน ปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่องเช่นนี้เรียกว่า กัมมันตภาพรังสี ซึ่งเป็นการเปลี่ยนแปลงภายในนิวเคลียสของไอโซโทปที่ไม่เสถียรและเรียกธาตุที่มีสมบัติเช่นนี้ว่า ธาตุกัมมันตรังสี ธาตุต่างๆ ที่พบในธรรมชาติส่วนใหญ่มีเลขอะตอมสูงกว่า 83 ล้วนแต่แผ่รังสีได้ทั้งสิ้น
นอกจาก ธาตุกัมมันตรังสีในธรรมชาติแล้ว นักวิทยาศาสตร์ยังสามารถสังเคราะห์ ธาตุกัมมันตรังสีขึ้นมาได้ ซึ่งสามารถนำไปใช้ประโยชน์ในด้านต่างๆ ได้มากมาย และเออร์เนสต์ รัทเทอร์ฟอร์ด (Ernest Rutherford) ได้ศึกษาเพิ่มเติม และได้แสดงให้เห็นว่ารังสีที่แผ่ออกมาจากสารกัมมันตรังสีอาจเป็น รังสีแอลฟา ( - ray ) รังสีเบตา ( - ray) หรือ รังสีแกรมมา ( - ray) ซึ่งมีสมบัติต่าง ๆ กัน
(9).jpg)
สมบัติของรังสีบางชนิด

การสลายตัวของไอโซโทปกัมมันตรังสี
การที่ธาตุกัมมันตรังสีแผ่รังสีได้นั้นเป็นเพราะนิวเคลียสของธาตุไม่เสถียร เนื่องจากมีพลังงานส่วนเกินอยู่ภายใน ดังนั้นจึงจำเป็นต้องถ่ายเทพพลังงานส่วนเกินนี้ออกไป เพื่อให้นิวเคลียสเสถียรในที่สุด พลังงานส่วนเกินที่ปล่อยออกมาอยู่ในรูปของอนุภาคหรือรังสีต่าง ๆ เช่น อนุภาคแอลฟา อนุภาคบีตา รังสีแกมมาและไอโชโทปที่เสถียร
ธาตุกัมมันตรังสีในธรรมชาติ
ธาตุต่างๆที่พบในธรรมชาตินั้น ธาตุที่มีเลขอะตอมตั้งแต่ 83 ขึ้นไป ส่วนใหญ่สามารถแบ่งรังสีได้เช่น92238U 92235U 90232Th 86222Rn หรืออาจจะเขียนเป็น U-238, U-235, Th-232, Rn-222
นอกจากธาตุกัมมันตรังสีจะพบในธรรมชาติแล้ว นักวิทยาศาสตร์ยังสังเคราะห์ธาตุกัมมันตรังสีขึ้น
เพื่อใช้ประโยชน์ในด้านต่างๆอีกด้วย ซึ่งมีหลายวิธี แต่มีวิธีหนึ่งคือยิงนิวเคลียสของไอโซโทปที่เสถียรด้วยอนุภาคที่เหมาะสม และมีความเร็วสูง ได้ไอโซโทปของธาตุใหม่ที่เสถียร เช่น รัทเทอร์ฟอร์ด ได้ยิงนิวเคลียส N-14 ด้วยอนุภาคแอลฟา เกิด O-17
เขียนแผนภาพแทน คือ 14N( ) 17O ไอโซโทป817O ที่เสถียร พบในธรรมชาติ0.037%
การแผ่รังสีแอลฟา
เมื่อไอโซโทปกัมมันตรังสีให้อนุภาคแอลฟา นิวเคลียสของไอโซโทปเสีย 2 โปรตอน และ 2นิวตรอน ดังนั้น ไอโซโทปกัมมันตรังสีจะเปลี่ยนไปเป็นธาตุอื่นที่มีเลขเชิงอะตอมต่ำกว่าเดิม 2 อะตอมและมีมวลต่ำกว่าเดิม 4 amu ตัวอย่างเช่น เมื่อ 92238U ให้อนุภาคแอลฟา ผลที่เกิดขึ้นจะให้ 90234Th สมการของปฏิกิริยาที่เกิดขึ้นเป็นดังนี้
92238U 24He+90234Th
จากสมการจะเห็นว่า ผลรวมของเลขเชิงอะตอมของด้านหนึ่งของสมการจะเท่ากันกับผลรวมของเลขเชิงอะตอมของอีกด้านหนึ่งของสมการ หรือ 92=2+90 ส่วนผลรวมของเลขมวลจะเท่ากันทั้ง 2 ด้านของสมการเช่นเดียวกันหรือ 238=4+234
การแผ่รังสีบีตา
การให้รังสีบีตาจะเกิดนิวเคลียสที่มีสัดส่วนของจำนวนนิวตรอนมากกว่าโปรตอน ตัวอย่างเช่น การแผ่รังสีบีตาของC-14 ไปเป็น N-14 C-14 ให้อนุภาคบีตา อนุภาคบีตาหรืออิเล็กตรอนเชื่อกันว่ามาจากนิวเคลียส เมื่อนิวตรอนสลายตัวไปเป็นโปรตอน 11H และอิเล็กตรอนดังนี้
01n----------> 11H+-10e
เมื่ออิเล็กตรอนเกิดขึ้น อิเล็กตรอนจะถูกปล่อยออกจากนิวเคลียสด้วยความเร็วสูงแต่โปรตอนยังคงอยู่ผลที่เกิดขึ้นทำให้นิวเคลียสมีจำนวนนิวตรอนลดลงไป 1 นิวตรอน และมีโปรตอนเพิ่มขึ้นอีก 1 โปรตอน ในกรณี C-14 ให้อนุภาคบีตา สมการ นิวเคลียร์จะเป็นดังนี้
614C------- >714 N+-10e
จากสมการจะเห็นว่าเลขเชิงอะตอมเพิ่มขึ้น 1 หน่วย และเลขมวลมีค่าคงที่
การแผ่รังสีแกมมา
การให้อนุภาคแอลฟาหรืออนุภาคอย่างใดอย่างหนึ่ง มักจะติดตามด้วยการแผ่รังสีแกมมา รังสีแกมมาถูกปล่อยออกมาเมื่อนิวเคลียสเปลี่ยนจากสถานะเร้าหรือสถานะพลังงานสูง ไปยังสถานะที่มีพลังงานต่ำกว่าเนื่องจากรังสีแกมมาไม่มีทั้งประจุและมวล การแผ่รังสีแกมมาจึงไม่ทำให้มีการเปลี่ยนแปลงเลขมวลหรือเลขเชิงอะตอมของนิวเคลียสอย่างใดอย่างหนึ่ง รังสีแกมมานำไปใช่รักษาโรค เป็นรังสีแกมมาที่มาจากเทคนิเทียม
4399Tc------> 4399Tc+y
เมื่อ Ra-226เปลี่ยนไปเป็น Rn-222 โดยการแผ่รังสีแอลฟานั้น Rn-222 ไม่เสถียรภาพจึงแผ่รังสีแกมมาออกมา
อันตรายจากไอโซโทปกัมมันตรังสี
โดยปกติแล้วสิ่งมีชีวิตในโลกได้รับกัมมันตภาพรังสีโดยตามธรรมชาติ แต่ก็เป็นปริมาณน้อยไม่ถึงกับเป็นอันตราย การบำบัดโรคด้วยสารกัมมันตภาพรังสีหรือการตั้งถิ่นฐานอยู่ใกล้โรงไฟฟ้านิวเคลียร์ จะทำให้ร่างกายได้รับกัมมันตภาพรังสีในปริมาณสูง แต่ก็ยังไม่เป็นอันตรายเฉียบพลัน เหมือนกับอยู่ในเหตุการณ์การระเบิดของระเบิดปรมาณูหรือการระเบิดในโรงไฟฟ้านิวเคลียร์ อาการที่ปรากฏหลังร่างกายได้รับกัมมันตภาพรังสี จะมีอาการคลื่นไส้ อาเจียน ปวดศีรษะ แต่ส่วนใหญ่แล้วอาการเหล่านี้จะไม่ปรากฏในทันที ดังนั้น ประชาชนและผู้เกี่ยวข้องกับกัมมันตรังสีจึงไม่ใส่ใจต่อการป้องกันอันตราย
สัญลักษณ์เตือนภัยจากรังสี
ในหนังสือศัพทานุกรมนิวเคลียร์ ที่จัดพิมพ์เผยแพร่โดยสำนักงานปรมาณูเพื่อสันติเมื่อปี พ.ศ. 2548 ได้ให้คำอธิบายศัพท์ “สัญลักษณ์เตือนภัยจากรังสี (radiation warning sign)” ไว้ ว่า “สัญลักษณ์สากลที่กำหนดขึ้น เพื่อเตือนให้ทราบว่ามีรังสี หรือให้ระวังรังสี ประกอบด้วยใบพัด 3 แฉก สีม่วงหรือสีดำ อยู่บนพื้นสีเหลือง สัญลักษณ์นี้ใช้ติดที่ภาชนะบรรจุวัสดุกัมมันตรังสีหรือบริเวณรังสี”

ล่าสุดในปี ค.ศ. 2007 มีการออกสัญลักษณ์ใหม่สำหรับเตือนอันตรายจากรังสี สัญลักษณ์ที่ออกเพิ่มขึ้นนี้ มีวัตถุประสงค์ที่จะช่วยลดการบาดเจ็บหรือเสียชีวิตโดยไม่จำเป็น

ครึ่งชีวิตของไอโซโทปกัมมันตรังสี
ครึ่งชีวิตของธาตุ (half life) หมายถึง ระยะเวลาที่สารสลายตัวไปจนเหลือเพียงครึ่งหนึ่งของปริมาณเดิมใช้สัญลักษณ์เป็น t1/2 นิวเคลียสของธาตุกัมมันตรังสีที่ไม่เสถียร จะสลายตัวและแผ่รังสีได้เองตลอดเวลาโดยไม่ขึ้นอยู่กับอุณหภูมิหรือความดัน อัตราการสลายตัว เป็นสัดส่วนโดยตรงกับจำนวนอนุภาคในธาตุกัมมันตรังสีนั้น ปริมาณการสลายตัวจะบอกเป็นครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป
ตัวอย่างเช่น C-14 มีครึ่งชีวิต 5730 ปี หมายความว่า ถ้ามี C-14 1 กรัม เมื่อเวลาผ่านไป 5730 ปี จะเหลือ C-14 อยู่ 0.5 กรัม และเมื่อเวลาผ่านไปอีก 5730 ปี จะเหลืออยู่ 0.25 กรัม เป็นดังนี้ไปเรื่อยๆ กล่าวได้ว่าทุกๆ 5730 ปี จะเหลือ C-14เพียงครึ่งหนึ่งของปริมาณเดิม
ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป และสามารถใช้เปรียบเทียบอัตราการสลายตัวของธาตุกัมมันตรังสีแต่ละชนิดได้ ตัวย่างครึ่งชีวิตของไอโซโทปกัมมันตรังสีบางชนิด ครึ่งชีวิตของธาตุกัมมันตรังสีชนิดต่างๆมีค่าไม่เท่ากัน เช่น เทคนีเทียม -99 มีครึ่งชีวิต 6 ชั่วโมงเท่านั้น ส่วนยูเรเนียม -235 มีครึ่งชีวิต 4.5 ล้านปี
ครึ่งชีวิต (half life) ของสารกัมมันตรังสี สามารถนำไปใช้หาอายุอายุสัมบูรณ์ (Absolute Age) เป็นอายุของหินหรือซากดึกดำบรรพ์ ที่สามารถบอกจำนวนปีที่ค่อนข้างแน่นอน การหาอายุสัมบูรณ์ใช้วิธีคำนวณจากครึ่งชีวิต ของธาตุกัมมันตรังสีที่มีอยู่ในหิน หรือซากดึกดำบรรพ์ที่ต้องการศึกษา ธาตุกัมมันตรังสีที่นิยมนำมาหาอายุสัมบูรณ์ได้แก่ ธาตุคาร์บอน – 14 ธาตุโพแทศเซียม – 40 ธตาเรเดียม – 226 และธาตุยูเรเนียม – 238 เป็นต้น การหาอายุสัมบูรณ์มักใช้กับหินที่มีอายุมากเป็นแสนล้านปี เช่น หินแกรนิตบริเวณฝั่งตะวันตกของเกาะภูเก็ต ซึ่งเคยเป็นหินต้นกำเนิดแร่ดีบุกมีอายุสัมบูรณ์ประมาณ 100 ล้านปี ส่วนตะกอนและซากดึกดำบรรพ์ที่มีอายุน้อยกว่า 50,000 ปี มักจะใช้วิธีกัมมันตภาพรังสีคาร์บอน – 14 เช่น ซากหอยนางรมที่วัดเจดีย์หอย อำเภอลาดหลุมแก้ว จังหวัดปทุมธานี มีอายุประมาณ 5,500 ปีของวัตถุโบราณ
นอกจากนั้นยังใช้คำนวณอายุของโลก พบว่าว่าประมาณครึ่งหนึ่งของยูเรเนียมที่มีมาแต่แรกเริ่มได้สลายตัวเป็นตะกั่วไปแล้ว ดังนั้นอายุของโลกคือประมาณครึ่งชีวิตของยูเรเนียม หรือราว 4,500 ล้านปี
ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป และสามารถใช้เปรียบเทียบอัตราการสลายตัวของธาตุกัมมันตรังสีแต่ละชนิดได้ ตัวย่างครึ่งชีวิตของไอโซโทปกัมมันตรังสีบางชนิด ครึ่งชีวิตของธาตุกัมมันตรังสีชนิดต่างๆมีค่าไม่เท่ากัน เช่น เทคนีเทียม -99 มีครึ่งชีวิต 6 ชั่วโมงเท่านั้น ส่วนยูเรเนียม -235 มีครึ่งชีวิต 4.5 ล้านปี
ครึ่งชีวิต (half life) ของสารกัมมันตรังสี สามารถนำไปใช้หาอายุอายุสัมบูรณ์ (Absolute Age) เป็นอายุของหินหรือซากดึกดำบรรพ์ ที่สามารถบอกจำนวนปีที่ค่อนข้างแน่นอน การหาอายุสัมบูรณ์ใช้วิธีคำนวณจากครึ่งชีวิต ของธาตุกัมมันตรังสีที่มีอยู่ในหิน หรือซากดึกดำบรรพ์ที่ต้องการศึกษา ธาตุกัมมันตรังสีที่นิยมนำมาหาอายุสัมบูรณ์ได้แก่ ธาตุคาร์บอน – 14 ธาตุโพแทศเซียม – 40 ธตาเรเดียม – 226 และธาตุยูเรเนียม – 238 เป็นต้น การหาอายุสัมบูรณ์มักใช้กับหินที่มีอายุมากเป็นแสนล้านปี เช่น หินแกรนิตบริเวณฝั่งตะวันตกของเกาะภูเก็ต ซึ่งเคยเป็นหินต้นกำเนิดแร่ดีบุกมีอายุสัมบูรณ์ประมาณ 100 ล้านปี ส่วนตะกอนและซากดึกดำบรรพ์ที่มีอายุน้อยกว่า 50,000 ปี มักจะใช้วิธีกัมมันตภาพรังสีคาร์บอน – 14 เช่น ซากหอยนางรมที่วัดเจดีย์หอย อำเภอลาดหลุมแก้ว จังหวัดปทุมธานี มีอายุประมาณ 5,500 ปีของวัตถุโบราณ
นอกจากนั้นยังใช้คำนวณอายุของโลก พบว่าว่าประมาณครึ่งหนึ่งของยูเรเนียมที่มีมาแต่แรกเริ่มได้สลายตัวเป็นตะกั่วไปแล้ว ดังนั้นอายุของโลกคือประมาณครึ่งชีวิตของยูเรเนียม หรือราว 4,500 ล้านปี
ตัวอย่างครึ่งชีวิตของไอโซโทปกัมมันตรังสี

ปฏิกิริยานิวเคลียร์
ปฏิกิริยานิวเคลียร์ คือ ปฏิกิริยาที่เกิดความเปลี่ยนแปลงกับนิวเคลียสของอะตอม ไม่ว่าจะเป็นการเพิ่ม หรือลดโปรตอน หรือนิวตรอนในนิวเคลียสของอะตอม เช่น ปฏิกิริยานี้
จะเห็นได้ว่าโซเดียม ได้มีการรับนิวตรอนเข้าไป เมื่อนิวเคลียสเกิดความไม่เสถียร จึงเกิดการคายพลังงานออกมา และพลังงานที่คายออกมานั้น เมื่ออยู่ในรูปคลื่นแม่เหล็กไฟฟ้าแล้ว มันก็คือรังสีแกมมานั่นเอง
โดยทั่วไปรังสีแกมมาที่แผ่ออกมาจากนิวเคลียสของอะตอมที่ไม่เสถียรนั้น มักจะมีค่าพลังงานที่แตกต่างกันไปตามแต่ละชนิดของไอโซโทป ซึ่งถือเป็นคุณลักษณะประจำไอโซโทปนั้น ๆ
ปฏิกิริยานิวเคลียร์นั้นมีมากมายหลายรูปแบบ ซึ่งในบรรดารูปแบบทั้งหมดที่เราค้นพบในปัจจุบัน จะมีเพียง 2 รูปแบบที่เราพูดถึงกันบ่อย ๆ นั่นก็คือปฏิกิริยานิวเคลียร์ฟิชชัน (Fission) และปฏิกิริยานิวเคลียร์ฟิวชัน (Fusion)
ปฏิกิริยานิวเคลียร์ฟิชชัน
โมเดลแสดงการเกิดปฏิกิริยานิวเคลียร์ฟิชชัน
ปฏิกิริยานิวเคลียร์ฟิชชัน (Fission Process) เป็นการแตกนิวเคลียสของอะตอมจากอะตอมของธาตุใหญ่ให้กลายเป็นอะตอมของธาตุเล็ก 2 อะตอม ซึ่งในกระบวนการนี้จะให้พลังงานออกมาด้วย เช่น
ซึ่งในปฏิกิริยาที่ยกตัวอย่างนี้ ไอโซโทปของแบเรียม (Ba) และคริปตอน (Kr) ซึ่งไอโซโทปทั้งสองตัวนี้มีนิวตรอนมากกว่าปกติ จึงมีการคายพลังงานออกมาในรูปของรังสีเบตา
อย่างไรก็ตาม ถึงแม้ว่าในตัวอย่างนี้สารผลิตภัณฑ์ที่ได้จากปฏิกิริยาจะเป็นกากกัมมันตรังสีที่แผ่รังสีเบตา (Beta Ray) แต่ก็ยังมีปฏิกิริยาอื่น ๆ ที่แผ่รังสีชนิดอื่น ๆ รวมไปถึงรังสีแกมมา ตัวอย่างนี้เป็นเพียงการทำให้เห็นภาพว่าผลิตภัณฑ์ที่ได้จากปฏิกิริยา นิวเคลียร์ฟิชชันจะคายพลังงานออกมา นั่นก็เป็นเพราะโดยทั่วไปเมื่อธาตุที่มีมวลหรือเป็นธาตุหนักขึ้น จำนวนของนิวตรอนก็เริ่มที่จะมากกว่าโปรตอนไปด้วยตามลำดับ ซึ่งเมื่ออะตอมเหล่านี้แตกตัวมาเป็นอะตอมของธาตุที่เล็กกว่า ก็ย่อมทำให้จำนวนนิวตรอนของอะตอมมากกว่าปกติ
ปฏิกิริยานิวเคลียร์ฟิวชัน
โมเดลแสดงการเกิดปฏิกิริยานิวเคลียร์ฟิวชัน
สำหรับปฏิกิริยานิวเคลียร์ฟิวชัน (Fusion Process) จะตรงข้ามกับฟิชชัน นั่นคือแทนที่จะแตกอะตอมของธาตุหนักให้เป็นธาตุเบา ก็จะกลายเป็นการรวมธาตุเบาสองอะตอมให้กลายเป็นอะตอมเดียวที่หนักขึ้น เช่นตัวอย่างนี้
จะเห็นได้ว่า ผลิตภัณฑ์ของปฏิกิริยานี้ เราจะได้ฮีเลียม (He) ที่มีจำนวนนิวตรอนน้อยกว่าปกติ (ปกติฮีเลียมจะมีนิวตรอน 2 ตัว) ซึ่งสภาพที่ไม่เสถียรของอะตอมนี้เอง จึงทำให้เกิดการคายพลังงานออกมาได้
เทคโนโลยีที่เกี่ยวข้องกับการใช้สารกัมมันตรังสี
1. ด้านธรณีวิทยา มีการใช้ C-14 คำนวณหาอายุของวัตถุโบราณ หรืออายุของซากดึกดำบรรพ์ซึ่งหาได้ดังนี้ ในบรรยากาศมี C-14 ซึ่งเกิดจากไนโตรเจน รวมตัวกับนิวตรอนจากรังสีคอสมิกจนเกิดปฏิกิริยา แล้ว C-14 ที่เกิดขึ้นจะทำปฏิกิริยากับก๊าซออกซิเจน แล้วผ่านกระบวนการสังเคราะห์แสงของพืช และสัตว์กินพืช คนกินสัตว์และพืช ในขณะที่พืชหรือสัตว์ยังมีชีวิตอยู่ C-14 จะถูกรับเข้าไปและขับออกตลอดเวลา เมื่อสิ่งมีชีวิตตายลง การรับ C-14 ก็จะสิ้นสุดลงและมีการสลายตัวทำให้ปริมาณลดลงเรื่อยๆ ตามครึ่งชีวิตของ C-14 ซึ่งเท่ากับ 5730 ปี
ดังนั้น ถ้าทราบอัตราการสลายตัวของ C-14 ในขณะที่ยังมีชีวิตอยู่และทราบอัตราการสลายตัวในขณะที่ต้องการคำนวณอายุวัตถุนั้น ก็สามารถทำนายอายุได้ เช่น ซากสัตว์โบราณชนิดหนึ่งมีอัตราการสลายตัวของ C-14 ลดลงไปครึ่งหนึ่งจากของเดิมขณะที่ยังมีชีวิตอยู่เนื่องจาก C-14 มีครึ่งชีวิต 5730 ปี จึงอาจสรุปได้ว่าซากสัตว์โบราณชนิดนั้นมีอายุประมาณ 5730 ปี
2. ด้านการแพทย์ ใช้รักษาโรคมะเร็ง ในการรักษาโรคมะเร็งบางชนิด กระทำได้โดยการฉายรังสีแกมมาที่ได้จาก โคบอลต์-60 เข้าไปทำลายเซลล์มะเร็ง ผู้ป่วยที่เป็นมะเร็งในระยะแรกสามารถรักษาให้หายขาดได้ แล้วยังใช้โซเดียม-24 ที่อยู่ในรูปของ NaCl ฉีดเข้าไปในเส้นเลือด เพื่อตรวจการไหลเวียนของโลหิต โดย โซเดียม-24จะสลายให้รังสีบีตาซึ่งสามารถตรวจวัดได้ และสามารถบอกได้ว่ามีการตีบตันของเส้นเลือดหรือไม่
3. ด้านเกษตรกรรม มีการใช้ธาตุกัมมันตรังสีติดตามระยะเวลาการหมุนเวียนแร่ธาตุในพืช โดยเริ่มต้นจากการดูดซึมที่รากจนกระทั่งถึงการคายออกที่ใบ หรือใช้ศึกษาความต้องการแร่ธาตุของพืช
4. ด้านอุตสาหกรรม ในอุตสาหกรรมการผลิตแผ่นโลหะ จะใช้ประโยชน์จากกัมมันตภาพรังสีในการควบคุมการรีดแผ่นโลหะ เพื่อให้ได้ความหนาสม่ำเสมอตลอดแผ่น โดยใช้รังสีบีตายิงผ่านแนวตั้งฉากกับแผ่นโลหะที่รีดแล้ว แล้ววัดปริมาณรังสีที่ทะลุผ่านแผ่นโลหะออกมาด้วยเครื่องวัดรังสี ถ้าความหนาของแผ่นโลหะที่รีดแล้วผิดไปจากความหนาที่ตั้งไว้ เครื่องวัดรังสีจะส่งสัญญาณไปควบคุมความหนา โดยสั่งให้มอเตอร์กดหรือผ่อนลูกกลิ้ง เพื่อให้ได้ความหนาตามต้องการ
ในอุตสาหกรรมการผลิตถังแก๊ส อุตสาหกรรมก่อสร้าง การเชื่อมต่อท่อส่งน้ำมันหรือแก๊สจำเป็นต้องตรวจสอบความเรียบร้อยในการเชื่อต่อโลหะ เพื่อต้องการดูว่าการเชื่อมต่อนั้นเหนียวแน่นดีหรือไม่ วิธีการตรวจสอบทำได้โดยใช้รังสีแกมมายิงผ่านบริเวณการเชื่อมต่อ ซึ่งอีกด้านหนึ่งจะมีฟิล์มมารับรังสีแกมมาที่ทะลุผ่านออกมา ภาพการเชื่อมต่อที่ปรากฏบนฟิล์ม จะสามารถบอกได้ว่าการเชื่อมต่อนั้นเรียบร้อยหรือไม่
ประโยชน์ของพลังงานนิวเคลียร์



















ไม่มีความคิดเห็น:
แสดงความคิดเห็น